¿Que es la materia?
Con palabras sencillas, podemos decir que materia es todo lo que existe, ocupa un espacio y se puede pesar. Materia son los cuerpos que vemos, tocamos, medimos, etc. De una forma más rigurosa, materia se define como:
Materia es todo lo que existe, tiene masa y volumen.
La masa y el volumen son dos propiedades fundamentales de la materia que estudiaremos en este tema.
Si pudiéramos ver los cuerpos materiales con un microscopio muy potente. Veríamos que todos los cuerpos están formados por unas pequeñas partículas llamadas
átomos.
Hay átomos de diferentes tipos. Los átomos se pueden diferenciar entre sí por su masa ( unos pesan más que otros), por su tamaño (unos mayores que otros) y por la forma que tienen de unirse a otros átomos.
Todos los cuerpos materiales están formados por unas partículas llamadas átomos.
En este tema consideraremos a los átomos como eternos e indestructibles.
Unión de átomos
Los átomos pueden unirse entre si, formando compuestos. Estos átomos que se unen pueden ser iguales o distintos. Cuando los átomos se unen se dice que forman enlaces.
La fuerza con la que se unen los átomos depende del tipo o naturaleza de los átomos que se unen.
Hay átomos que se atraen entre sí con mucha fuerza y se unen muy fuertemente y otros que prácticamente no se atraen nada y no se unen.
Los átomos dependiendo de su naturaleza pueden unirse entre sí formando enlaces.
Temperatura
Intuitivamente asociamos la temperatura de un cuerpo a si éste está caliente o frío. La pregunta es: ¿qué diferencia hay entre un cuerpo con más temperatura que otro con menos?
Si mirásemos las partículas o átomos que componen un cuerpo, veíamos que éstas se mueven, y se mueven más rápido cuanto mayor es la temperatura del cuerpo y viceversa. Si las partículas ganan energía aumenta la temperatura y si la pierden baja.
La temperatura está directamente relacionada con la rapidez (velocidad) o energía que tienen los átomos o partículas que componen los cuerpos.
El aparato más utilizado para medir la temperatura es el termómetro.
Teoría cinética de la materia
Los cuerpos están formados por átomos, que pueden unirse entre sí, tienen energía y están en movimiento. Que los átomos estén unidos o separados entre sí depende de dos factores:
- De la fuerza con la que los átomos se atraen, que depende del tipo de átomos que se unen.
- De la temperatura o energía que poseen los átomos. Si los átomos se mueven más rápido (mas temperatura) será más fácil que se separen que si se mueven más lentos (menos temperatura)
Que los átomos estén unidos entre sí depende del tipo de átomos y de la temperatura.
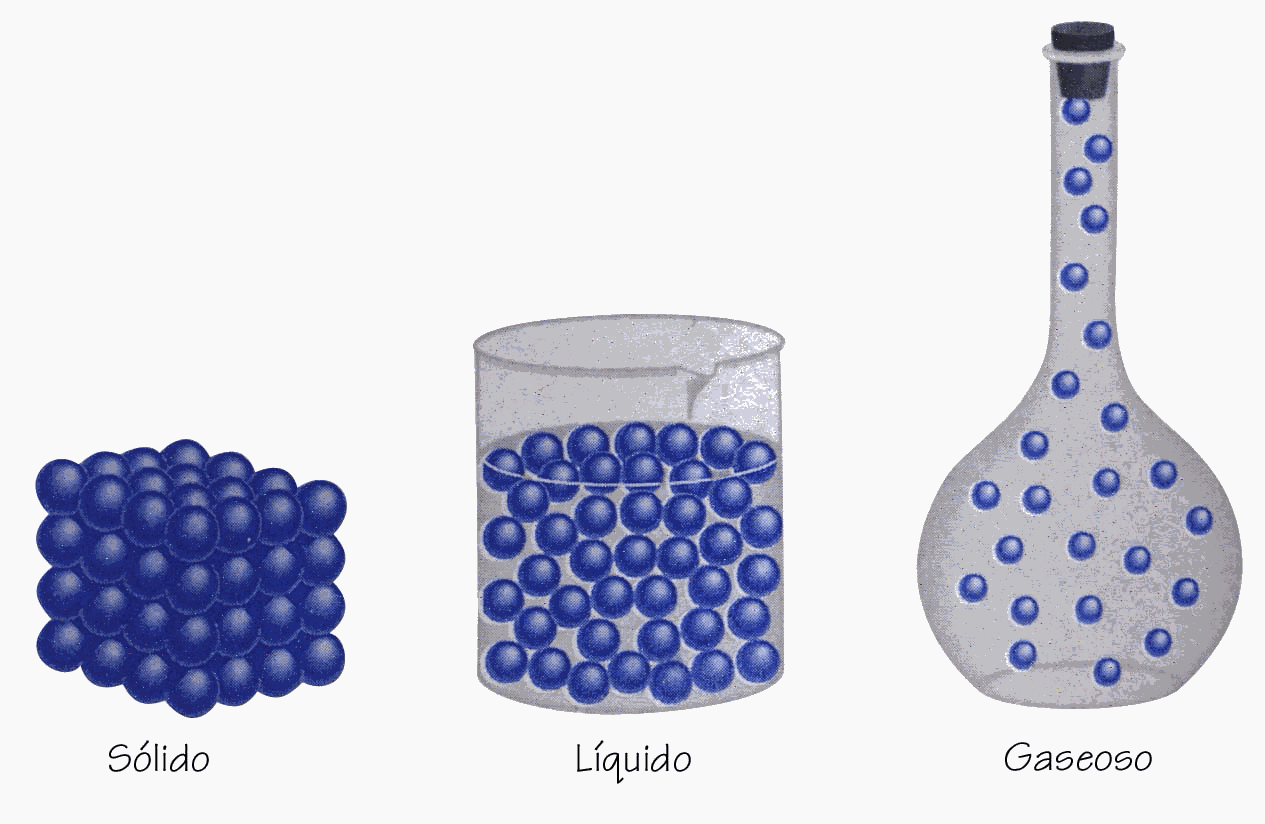
Por ello, las sustancias están en estado sólido, líquido o gas.
Estado de la materia
Gaseoso
Las partículas de los gases se atraen muy poco entre sí y están separadas.
La estructura microscópica de los gases explica que presenten las siguientes propiedades:
Su forma y su volumen es la del recipiente que los contiene. Se pueden comprimir (reducir o aumentar su tamaño). Pueden fluir (viajar de un sitio a otro deslizándose por el medio). Los gases ejercen presión (fuerza sobre las paredes del recipiente que contienen).
Las temperaturas altas favorecen que las sustancias estén en estado gaseoso.
Sólido
Las pàrtículas de los sólidos se atraen con mucha fuerza entre sí y están fuertemente unidas.
La estructura microscópica de los sólidos explica que presenten las siguientes propiedades:
Su forma y su volumen son fijos y no varían. Son incomprensibles ( no se reducen al ser presionados). No fluyen. Los sólidos ejercen presión sólo sobre los cuerpos que están apoyados en él.
Las temperaturas bajas favorecen que las sustancias estén en estado sólido.
Líquido
Las partículas de los líquidos se atraen con fuerza intermedia entre si y las partículas están unidas pero se mueven o deslizan unas con respecto de otras.
La estructura microscópica de los líquidos explica que presenten las siguientes propiedades:
Su forma es la del recipiente que lo contiene y su volumen es fijo, no varía Son incompresibles (no se reducen al ser presionados). Pueden fluir. Los líquidos ejercen presión sobre las paredes de los recipientes que los contienen.
Las temperaturas intermedias favorecen que las sustancias estén en estado líquido.
Propiedades de la materia
Masa
Todos los cuerpos tienen una masa. Una definición de la masa es: "cantidad de materia que tiene un cuerpo".
Otra manera más intuitiva de definir masa es: la masa de un cuerpo relaciona directamente con la cantidad de átomos o partículas que contiene. Cuantos más átomos más masa y viceversa.
La masa de un cuerpo mide la cantidad de átomos o partículas que contiene.
Nota: también depende del tipo de átomo ya que unos átomos tienen más masa que otros.
Volumen
Volumen es el espacio que ocupa un cuerpo.
Todos los cuerpos que existen tienen volumen, ya que ocupan un lugar en el espacio.
El volumen de un cuerpo es el que ocupan los átomos que lo componen más el espacio entre ellos (espacio interatómico).
El espacio ocupado por un cuerpo no puede ser ocupado por otro cuerpo a la vez (principio de impenetrabilidad de los cuerpos).
Densidad
Hemos visto que todos los cuerpos tienen masa y volumen, es decir que están formados por átomos que ocupan un espacio.
A la división entre la masa y el volumen de un cuerpo se le llama densidad. d=m/v
Los átomos de un cuerpo pueden estar más o menos juntos, es decir, en un mismo espacio puede haber más o menos átomos.
Un cuerpo denso es aquel que tiene muchos átomos en un espacio determinado, es decir, los átomos están muy juntos. Mientras que si hay mucho espacio entre ellos será poco denso.
Otras propiedades de la materia
Los cuerpos materiales tienen otras muchas propiedades. A continuación comentaremos algunas de ellas a modo de ejemplo:
- Dureza. Indica si es fácil o difícil de rayar.
- Índice de refracción. Indica si la luz y las ondas viajan más o menos rápido en el interior de un cuerpo.
- Calor específico. Indica si hay que dar más o menos energía para calentar o enfriar el cuerpo.
- Conductividad eléctrica y térmica. Indica si el calor y la electricidad pasan o no con facilidad a través del cuerpo.
Dimensiones de los cuerpos
En el espacio que conocemos hay tres dimensiones llamadas: ancho, largo y alto.
Todos los cuerpos son tridimensionales (3 dimensiones), por ejemplo: un balón, una silla, un coche, etc.
Sin embargo, hay cuerpos que tienen una dimensión mucho más pequeña que las otras dos. Son cuerpos bidimensionales. Por ejemplo, un folio, un mantel son muy finos y en la práctica se tienen en cuenta dos dimensiones: ancho y largo.
Hay cuerpos, como por ejemplo un hilo o una cuerda, en los que predomina una sola dimensíon, son cuerpos unidimensionales.
Cambios de estado
Hemos visto que el estado de una sustancia depende de dos factores: naturaleza de la sustancia (de ella depende la fuerza de unión entre sus átomos) y temperatura (de ella depende la energía o rapidez con la que se mueven los átomos).
Un cuerpo en estado sólido al que se aumenta su temperatura hace que sus partículas se muevan más rápido hasta que se separan y pasa a estado líquido o gaseoso. Lo contrario pasa si se baja la temperatura, las partículas tendrán menos energia y tenderán a estar en estado líquido o sólido.
Las temperaturas intermedias favorecen que las sustancias estén en estado líquido.
Magnitud, medida y unidades
Magnitud. Es cualquier propiedad (del universo) que se puede medir o calcular de alguna forma. Ejemplos: tiempo, masa, fuerza, longitud, velocidad, aceleración, etc.
Medida. Es el resultado de comparar dos magnitudes de la misma naturaleza. Ejemplo: cuando se mide el tiempo se compara lo que tarda en ocurrir algo con lo que tardan las agujas del reloj en dar las vueltas, estoy comparando un tiempo (fenómeno) con otro (reloj).
Unidad de medida. Cantidad de una determinada magnitud que se toma como referencia. Actualmente las establece el Sistema Internacional de unidades (S.I.).
Sistema Internacional (SI)
El sistema Internacional (SI) es un sistema de unidades establecido por una conferencia internacional.
El SI también se llama "sistema métrico" y fue creado en 1960. La gran mayoría de los países utiliza este sistema de unidades.
Magnitudes. El SI ha establecido siete magnitudes como fundamentales o básicas. Todas las demás son derivadas y utilizan a las fundamentales para definirse.
Unidad de medida. El SI asigna una magnitud a cada unidad. También establece las equivalencias entre las unidades del SI y otras unidades de la misma magnitud.
Conversión de unidades
Las unidades pueden tener múltiplos o submúltiplos que son prefijos que se colocan delante de la unidad y que la multiplican o dividen respectivamente por la unidad seguida de ceros.
Ejemplo: un kilómetro son mil metros (kilo multiplica por mil al metro).
Una misma magnitud puede medirse con distintas unidades, una de ellas es elegida por el SI y las otras no, pero tienen una equivalencia entre ellas. Ejemplo: metros y millas. Ambos miden longitud, pero el metro es la unidad del SI
Para convertir unas unidades en otras, o para cambiar entre los múltiplos y submúltiplos de una misma unidad, se pueden usar: multiplicación o división por la unidad seguida de ceros, las reglas de tres, fórmulas y los factores de conversión.
Masa
Masa. Cantidad de materia que tiene un cuerpo.
Tipo de magnitud: fundamental.
Unidad SI: Kilogramo (kg)
Instrumentos de medida: balanza, báscula, granatorio, peso...
Otras unidades: libra onza, UTM, arroba, quintal, grano, tonelada...
Ejemplo: 2 kg. La magnitud medida es la masa en la unidad kilogramos. La cantidad medida es 2 (hay 2 veces un kilogramo). Se ha medido con una balanza.
Longitud
Longitud. Distancia entre dos puntos.
Tipo de magnitud: fundamental.
Unidad SI: metro (s).
Instrumentos de medida: cinta métrica, regla de medir, técnicas láser...
Otras unidades: yarda, milla marina, milla terrestre, pie, cuarta, codo...
Ejemplo: 5 m. La magnitud medida es la longitud en la unidad metros. La cantidad medida es de 5 (hay 5 veces un metro). Se ha medido con una cinta métrica.
Tiempo
Tiempo. Duración de un fenómeno.
Tipo de magnitud: fundamental.
Unidad SI: segundo (s)
Instrumentos de medida: cronómetro, reloj digital, reloj de arena, clepsidra(reloj de agua)...
Otras unidades. minuto, hora, día, mes, año, cron, eón...
Ejemplo: 8 m. La magnitud medida es el tiempo en la unidad segundos. La cantidad medida es 8 (hay 8 veces un segundo). Se ha medido un cronómetro.
Temperatura
Temperatura. Medida de la cantidad de energía de las párticulas de un cuerpo.
Tipo de magnitud: fundamental
Unidad SI: Kelvin (K).
Instrumentos de medida: termómetro, termopar, resistencia eléctrica...
Otras unidades: Grado Celsius, Fahrenheit, Reaumur...
Ejemplo: 3K. La magnitud medida es la temperatura en la unidad kelvin. La cantidad medida es 3 (hay 3 veces Kelvin). Se ha medido con termómetro.
Superficie
Superficie. Espacio bidimensional que ocupa un cuerpo.
Tipo de magnitud: derivada.
Unidad SI: metro cuadrado (m2).
Medida: superficie = longitud 1 x longitud 2
Otras unidades: área, acre, milla cuadrada, rood...
Ejemplo: 2 m2. La magnitud medida es la superficie en la unidad metro cuadrado. La cantidad medida es 2 (hay 2 veces un metro cuadrado). Se ha medido con una fórmula (largo por ancho).
Volumen
Volumen. Espacio tridimensional que ocupa un cuerpo.
Tipo de magnitud: derivada
Unidad SI: metro cúbico (m3).
Medida: volumen = longitud1 x longitud2 x longitud3. Probeta, pipeta, bureta, matraz aforado...
Otras unidades: litro, barril, pinta, galón, gota, taza...
Ejemplo: 3 m
3. La magnitud medida es el volumen en la unidad metro cúbico. La cantidad medida es 3 (hay 3 veces un metro cúbico). Se ha medido con una fórmula (largo por ancho por alto).
Densidad
Densidad. Relación entre la masa que tiene un cuerpo y el espacio que éste ocupa.
Tipo de magnitud: derivada.
Unidad SI: kilogramo/ metro cúbico (kg/m3)
Medida: densidad = masa/volumen. Densímetro, picnómetro, balanza hidrostática...
Otras unidades: gramos por mililitro, onza por pulgada cúbica, slug por pie cúbico, libra por galón...
Ejemplo: 6kg/m3 . La magnitud medida es la densidad en la unidad kilogramo por metro cúbico. La cantidad medida es 6 (hay 6 veces un kilogramo en metro cúbico). Se ha medido con un densímetro.